在材料科学与地球化学的宏伟版图上,相图是揭示物质状态秘密的核心地图。它并非简单的图表,而是描绘了在不同温度与压力条件下,物质如何选择其最稳定存在形式的物理定律的可视化呈现。今天,我们聚焦于一个在工业和自然界中都至关重要的体系:氧化镁-氢氧化镁(MgO-Mg(OH)₂)。
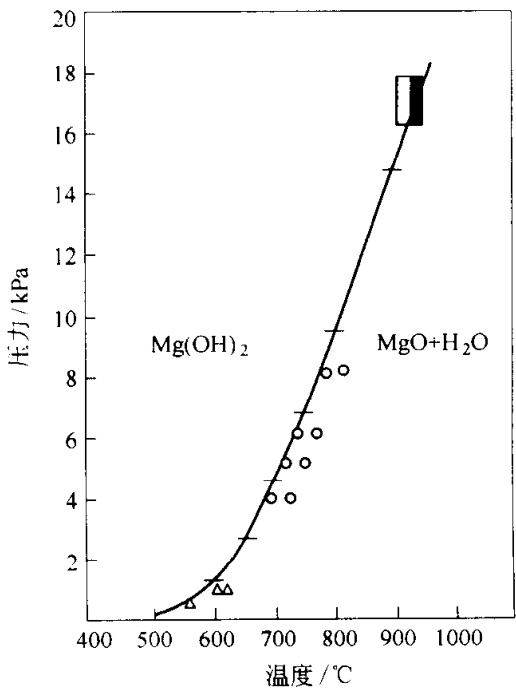
图 5-a MgO-Mg(OH)₂ 体系P-T图
上图所展示的,正是这个体系的压力-温度(P-T)相图。它简洁的线条背后,隐藏着一场关于结合与分离的持续博弈。这张图的核心是解答一个根本问题:在何种条件下,氢氧化镁(Mg(OH)₂,又称水镁石)会脱去水分,转变为更为致密和耐火的氧化镁(MgO,又称方镁石)?反之,氧化镁又将在何种环境中与水结合,发生水化反应?
首先,让我们建立坐标系。纵轴代表压力(P),横轴代表温度(T)。整个二维平面被一条关键的曲线分割为两个区域,这便是相界线。
那条蜿蜒的曲线,即是两者共存的平衡线。在这条线上任何一点所对应的P-T条件下,Mg(OH)₂、MgO和H₂O(g)三相可以达到热力学平衡。这就像水在100°C和标准大气压下沸腾的那个临界点,只不过这里描述的是一个固-固-气反应:
Mg(OH)₂(s) ⇌ MgO(s) + H₂O(g)
这条平衡线的斜率不是随意的,它严格遵循克劳修斯-克拉佩龙方程的约束。该方程揭示了相变潜热、体积变化与P-T斜率之间的深刻联系。由于Mg(OH)₂脱水是一个吸热反应(需要能量输入),且会产生气体导致体积急剧增大,因此平衡曲线呈现出正斜率——提高压力会抑制反应,需要更高的温度才能驱动其发生。
这张图的价值远不止于理论。设想一个场景:你是一位陶瓷工程师,目标是利用Mg(OH)₂粉末作为前驱体,通过煅烧来制造高性能的MgO绝缘陶瓷。
这张P-T图就是你的工艺指南。它告诉你,为了确保Mg(OH)₂完全分解为MgO,煅烧温度必须显著高于当前压力下的平衡温度。如果温度不足,产品中就会残留未反应的Mg(OH)₂,这将严重损害最终陶瓷的致密度、机械强度和高温电绝缘性能。反之,如果工艺中存在无法控制的水蒸气分压(相当于系统压力),那么即使在较高的温度下,脱水反应也可能不完全。
在地球深处,类似的过程同样上演。在地质构造运动中,含水的矿物(如水镁石)被带到更深、更热的地幔区域,它们会经历脱水变质作用,释放出水分,这些水分又可能诱发岩石的部分熔融,从而影响火山活动和板块构造。
因此,无论是优化工业煅烧炉的能效,还是理解地球内部的物质循环,精确控制和验证相变过程都显得至关重要。理论预测的相图为我们提供了宏观指导,但在真实的工业生产或科学研究中,原料的微量杂质、颗粒尺寸、升温速率等复杂因素都会对实际相变温度和动力学产生影响。要确保最终产物的相纯度、晶体结构和微观形貌符合预期,就必须依赖精准的实验数据进行验证。
精工博研测试技术(河南)有限公司(原郑州三磨所国家磨料磨具质量检验检测中心),专业的权威第三方检测机构,央企背景,可靠准确。欢迎沟通交流,电话19939716636


 首页
首页
 检测领域
检测领域
 服务项目
服务项目
 咨询报价
咨询报价