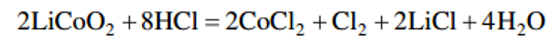 如果您在锂电池各类材料生产、制造、回收和质量控制方面有任何问题,欢迎沟通交流,国磨质检,您忠实的朋友!
如果您在锂电池各类材料生产、制造、回收和质量控制方面有任何问题,欢迎沟通交流,国磨质检,您忠实的朋友!浸出是从废旧电池正极材料中回收有价值金属的整个水冶金过程的第一步。浸出是将正极活性材料中的金属转化为溶液中的金属盐形式,然后可以通过沉淀、萃取、电解等各种化学方法进行分离和回收。常用的浸出剂是无机酸、有机酸、碱或细菌液。为了提高浸出效率,可以使用超声和机械化学方法进行辅助。根据浸出剂对金属的不同选择性,浸出可以分为全金属浸出和选择性浸出。
盐酸(HCl)、硫酸(H2SO4)和硝酸(HNO3)的无机酸来源广泛,成本低,常常是从废弃动力电池中浸出金属的浸出剂。然而,电池中的Co和Mn是不溶的Co3+和Mn4+。为了提高浸出效率,需要添加过氧化氢(H2O2)、亚硫酸钠或葡萄糖作为还原剂,将电池中的Co和Mn还原为更易溶解的Co2+和Mn2+。
Joulie等人研究并比较了H2SO4、HNO3和HCl三种无机酸对NCA三元电池正极材料的浸出效果,并优化了浸出温度、酸度、反应时间、浸出剂浓度、固液比和还原剂浓度。结果显示,当不添加还原剂时,酸的类型对金属浸出率影响较大。由于HCl中的氯离子可以促进Co3+的还原和溶解,而硫酸和硝酸中没有还原剂,Co和Mn以Co3+和Mn4+的高价态存在;在酸溶液中难以溶解。因此,HCl的浸出率最高。Xu等人用盐酸作为浸出剂浸出LiCoO2电池,得出了类似的结论,即氯离子的存在促进了Co的溶解。
具体机制如下:
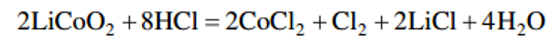
如前面的公式所示,HCl可以作为漂白剂和还原剂,促进Co的高效还原和浸出。但同时,HCl会被氧化产生Cl2,这对环境有害。因此,工业上通常使用硫酸或硝酸作为浸出剂。为了在无机酸浸出过程中提高Co和Mn的浸出率,通常会添加Na2S2O5、Na2SO3和H2O2等还原剂进行还原酸浸出,将正极材料中的Co3+和Mn4+还原为溶解性更好的Co2+和Mn2+。为了避免引入杂质离子,通常使用H2O2作为还原剂。 Lee和Rhee发现,当LiCoO2单独用HNO3浸出时,在最优参数下,Li和Co的浸出率分别只有75%和40%。但在添加1.7%(v/v)的H2O2后,由于Co3+可以被还原为Co2+,Co和Li的浸出率可以提高到99%以上。Chen等人的研究结果得出了类似的结论。当使用H2SO4作为浸出剂,H2O2作为还原剂时,锂电池中Co和Li的浸出率可以分别达到95%和96%。
无机酸浸出是一种相对成熟的工艺技术,对漂白剂的浓度、还原剂的用量、浸出温度、时间、固液比等进行了许多深入的研究。无论是HCl、H2SO4还是HNO3,Ni、Co、Mn、Li等的浸出率都可以大于90%,废旧锂电池的主流浸出技术是无机酸浸出。
目前工业上使用的浸出系统主要是无机酸,其浸出效率高,有价值金属的浸出率可以达到90%以上。然而,在工业应用中仍然存在一些无法避免的问题。首先,当使用无机酸浸出时,会释放出Cl2、SO3、NOx等有害气体,这对环境和人类健康构成严重威胁。其次,当使用无机酸浸出时,浸出液的pH值低,浸出液中的有价值金属难以直接回收。为了去除Al、Cu、Fe等杂质或回收Ni、Co、Mn等有价值金属,需要大量的碱来中和多余的酸。最后,浸出完成后会产生大量的酸性废水,需要后续处理和运营成本。 与无机酸相比,有机酸具有易降解、循环良好、二次污染少、酸度足以浸出正极材料的优点,有望成为无机酸浸出系统的替代品。研究发现,柠檬酸、草酸、乳酸、苹果酸、三氯乙酸、天冬酸、酒石酸等有机酸可以作为废旧电池回收的浸出剂。H2O2(1-6%)通常作为还原剂用于提高浸出效率。Zheng等人发现,当添加1%(v/v)的H2O2作为还原剂时,柠檬酸对LiCoO2中的Co的浸出效率可以达到99.07%。Zhang等人使用三氯乙烯作为浸出剂,H2O2作为还原剂。在最佳浸出条件下,Co、Ni、Mn和Li的浸出率分别可以达到91.8%、93.0%、89.8%和99.7%。
到目前为止,已经进行了许多关于有机酸浸出的研究报告,但在用于工业化之前,仍然有许多问题需要解决。首先,有机酸的价格高于无机酸,这导致回收成本增加。其次,有机酸的浸出速率慢,消耗时间长。最后,适合有机酸浸出的固液比低于无机酸,导致单位体积有机酸浸出正极材料的能力弱于无机酸。
与无机酸和有机酸相比,由于生物浸出对环境友好、成本低、对工业应用的要求低,因此在低品位矿物、废催化剂和飞灰的浸出过程中得到了广泛应用。然而,将其用于浸出废弃动力电池正极材料仍处于实验室研究阶段。
Xin等人使用三种能源源混合物培养了S氧化菌和Fe氧化菌,并研究了它们对正极材料的浸出性能。在S能源系统中,浸出液的pH值最低,Li的浸出率最高。对于Li的生物浸出,最主要的机制是酸溶解。在S+FeS2混合能源系统中,Co的浸出率最高,这表明Co的浸出不仅受酸溶解的影响,还受Fe2+的催化还原能力的影响,Co3+需要被Fe2+还原为Co2+才能在酸溶液中更好地溶解。
生物浸出的最明显缺点是浸出率低,限制了其工业应用。为了提高浸出率,Zeng等人发现,铜离子可以加速Co的浸出率。在没有铜离子的情况下,浸出10天后Co的浸出率只有43.1%,但是添加0.75 g/L的铜离子后,浸出六天后Co的浸出率可以达到99.9%。同样,Zeng等人发现,当添加一定量的银离子作为催化剂时,可以提高Co的浸出效率。Co的浸出率可以从没有添加银离子的结果43.1%,增加到浸出七天后(添加0.02 g/l银离子)的98.4%。与细菌相比,真菌具有更强的毒性耐受性,滞后期较短,浸出速率更快,被广泛用于从各种固体废物中回收重金属。在浸出过程中,真菌分泌各种有机酸,如苹果酸、葡萄糖酸、草酸和柠檬酸,可以有效地浸出重金属,浸出率高达100%、95%、70%、65%、45%和38%,分别对应Cu、Li、Mn、Al、Co和Ni,在1%的浆料密度下。
由于其低成本和环保性,生物浸出引起了广泛的研究,但一些未解决的问题限制了其工业化进程。一方面,生物浸出速率慢,所需的微生物难以有效培养,即使引入催化剂,生物浸出周期也长。另一方面,高浓度的金属离子对微生物有毒,生物浸出中的金属离子浓度低,后处理成本高。例如,当将浆料密度从2%增加到4%后,Co和Li的浸出率分别从89%和72%降低到10%和37%。浸液的低浓度无疑增加了后续处理的难度。
由于正极材料中含有多种金属,为了获得有价值的金属,通常需要进行多步骤的脱混和分离过程,回收过程较长。可以使用选择性浸出方法简化分离和回收过程。
Higuchi等人研究了一种选择性回收Li的方法:在硫酸浸出系统中添加Na2S2O8作为氧化剂,可以将Li氧化为水溶性的Li2SO4,Mn、Co和Ni分别氧化为不溶的MnO2、Co3O4和NiOOH,然后通过水浸出可以实现Li的选择性浸出。Meshram提出了一种选择性浸出Li和Co的方法:首先,通过在硫酸气氛中烧结300°C 30分钟,将Li和Co转化为LiCo(SO4)2、LiMnO3和Co3O4,然后通过水浸出,可以浸出78.6%的Li和80.4%的Co。同时,Ni和Mn的浸出率低于15%。Zhu等人使用硫酸作为漂白剂,适当的摩尔比选择性地浸出了锂钴酸和LFP电池中的Li和Co。Co和Li的浸出率均在96%以上。浸出液中钴和锂的浓度分别为64.41和17.23 g/L,铁和磷杂质的含量仅低于0.02 g/L;浸出残渣主要是磷酸铁和碳粉,磷酸盐可以通过煅烧或酸浸铁来回收。
由于Ni、Co和Mn的草酸盐会沉淀,而Li的草酸盐是可溶的,因此可以通过草酸选择性地浸出Li。Zeng等人使用草酸浸出LiCoO2。98%的Li可以被选择性地浸出,而Co以CoC2O4·2H2O沉淀的形式存在于渣中。Zhang等人研究了草酸对LNCM正极材料的浸出效果,Li的回收率为81%。Zhang研究了草酸对LNCM正极材料的浸出效果,Li的回收率为81%,纯度可以达到97%。而Ni、Co和Mn仍以草酸盐沉淀的形式存在于固体中。磷酸也可以用于选择性提取Li。Chen等人研究了磷酸浸出系统对LiCoO2的浸出效果,添加4 vol% H2O2作为还原剂到0.7M磷酸溶液中,可以将99%的Co和Li转化为Co3(PO4)2沉淀和LiH2PO4浸出液,从而实现Li和Co的分离。Bian等人研究了磷酸对LiFePO4的浸出效果,在浸出过程中,LiFePO4首先溶解为Li+、Fe3+和PO4 3−,然后Fe3+可以在85°C下转化为FePO4沉淀,而Li稳定地存在于浸出液中,从而实现Li和Fe的分离。
金属富集过程通常使用酸将正极材料中的金属浸出,无论是无机酸还是有机酸;通常可以浸出正极材料中的所有种类的金属,如Cu、Fe、Al、Ni、Co和Mn;金属浸出是不选择性的。由于铝是两性金属,可以在酸和碱溶液中溶解,而电极材料中的金属都不能与碱反应。因此,碱浸出法可以在酸浸出之前溶解铝箔。这可以避免在酸浸出过程中溶解铝,影响镍、钴、锰的回收。Nan等人发现,当使用10wt% NaOH,100 g/L固液比时,室温下反应五小时后,铝的浸出率可以达到98%,而钴和锂没有被浸出。Chen等人发现,将电极材料研磨后用5% NaOH处理四小时,铝的浸出率可以达到99.9%。

这种方法是一个简单的过程,铝的去除效率高,但由于其特殊的离子形式,难以从浸出液中回收铝,因此在工业上很少使用。并且会产生碱性废水,需要后续处理。
氨浸出对目标金属(Li、Ni和Co)和非目标金属(Fe、Mg、Al和Mn)具有选择性浸出效果。因此,可以通过氨浸出实现Ni、Co和Li的选择性浸出,避免Fe、Mg和Al等杂质的影响。Wang等人研究了不同还原剂和缓冲液下废弃NCM电池正极材料中价态金属元素的浸出行为差异,并详细分析了氨浸出过程。发现还原剂在没有额外的缓冲液的情况下促进了NCM材料中金属元素的浸出,但当添加亚硫酸铵作为还原剂时,抑制了铝元素的溶解。缓冲液可以有效地抑制铝元素的溶解,并提高除铝元素以外的其他金属元素的溶解效率。通过研究NH3–(NH4)2CO3–Na2SO3选择性氨浸出系统,发现单级浸出可以实现79.1%的锂、86.4%的钴和85.3%的镍的效率选择性浸出,而只有1.45%的锰进入溶液。多级浸出可以有效地浸出有价值的金属(98.4%的锂、99.4%的钴和97.3%的镍可以溶解)。Ku等人研究了NH3–(NH4)2CO3–Na2SO选择性氨浸出系统,其中亚硫酸铵在碳酸铵用作缓冲剂以确保pH稳定的条件下将Ni和Co还原为更易溶的二价离子,促进了Ni和Co与NH3的络合,使Co和Ni可以被选择性地浸出,但Mn和Al不能被浸出。从而,浸出可以实现Ni、Co、Mn和Al的分离。
无论是酸浸出还是碱浸出,通常都需要高温处理和长时间的浸出。为了提高浸出效率,通常可以使用一些辅助方法。
超声波是一种常见的辅助增强方法。已经证明,超声波有助于提高从各种材料中浸出有价值金属的速率。一方面,超声波促进了材料的对流运动和浸出过程中固体和液体之间的交换。另一方面,由于空化效应,大量的能量在固液界面释放,促进了金属元素的浸出速率的加速。Li等人研究了超声波辅助浸出锂电池活性正极材料。结果显示,在90W超声功率和酸和过氧化氢的双重作用下,钴的回收率为96.13%,锂为98.4%。Zhu等人发现,超声波可以提供非常高温度的热腔压力。热腔导致自由基反应,并诱导H2O2的产生,这有利于提高浸出效率。结果显示,通过超声波辅助浸出,在低H2SO4浓度下,浸出液中钴和锂的浸出效率显著提高。
机械活化可以通过机械力诱导矿物的晶体结构和物理化学性质的变化。部分机械能量转化为材料的内能,加速浸出反应的速率,达到增强浸出的目的。Guan等人发现,经过机械研磨和活化后,材料的粒度减小,比表面积增大,晶体结构发生转变,可以显著提高钴和锂的浸出效率。钴的浸出效率可以从23%提高到91%。
在极端环境中也可以增强正极材料的浸出效率。Bertuol等人使用过氧化氢和硫酸作为共溶剂,通过超临界CO2提取选择性浸出废旧锂电池中的Co。在反应时间为五分钟内,钴的回收率可以达到95.5%。然而,当只使用过氧化氢和硫酸时,需要60分钟的反应时间才能达到相同的效果。
化学沉淀方法通常用于浸出液的去除或产品的制备。化学沉淀是基于在一定的酸度和碱度下,金属化合物的溶解度不同来实现分离。废旧LIB浸出液通常含有有价值的金属离子如Li、Ni2+、Co2+和Mn2+,而液体中含有杂质金属离子如Al3+、Fe3+和Cu2+。一般来说,过渡金属的氢氧化物和草酸盐的溶解度远低于相应的锂化合物。此外,杂质金属离子如Fe3+、Al3+和Cu2+通常在相对较低的pH下沉淀。因此,应首先去除杂质离子,以避免在后续分离过程中的共沉淀,然后沉淀过渡金属离子,最后回收溶液中剩余的锂离子。化学沉淀过程中通常使用的沉淀剂是氢氧化钠、碳酸钠、草酸铵、高锰酸钾等。因此,为了实现金属组分的分离和回收,选择沉淀剂和沉淀条件是化学沉淀的关键。 基于化学沉淀方法,中国的研究人员使用KMnO4溶液选择性地分离和沉淀Mn2+,大约99.2%的Mn2+被去除并以MnO2和Mn2O3的形式沉淀。然后,使用Ni负载的Mextral® 272P作为新的萃取剂,从浸出液中分离和回收Co2+。最后,使用NaOH和Na3PO3溶液依次沉淀浸出液中剩余的Ni2+和Li+,经过过滤和干燥后,分别以Ni(OH)2和Li3PO4的形式回收Ni2+和Li+。在各自的最佳实验条件下,Cu、Mn、Co、Ni和Li的回收效率可以达到100%、99.2%、97.8%、99.1%和95.8%。
化学沉淀方法的优点是操作简单,分离效果好,设备要求低,但对工艺参数的要求更为严格。相反,沉淀过程可能导致金属离子的包裹和吸附,回收产品的纯度低,金属损失率高。
浸出后的溶液中含有钴、锂、镍等有价值的金属,以及铜、铁、铝、锰等杂质。最常研究的方法主要是溶剂萃取和化学沉淀。
溶剂萃取法广泛用于分离和回收废旧锂电池的金属元素。其原理是利用有机溶剂和浸出溶液中的目标离子形成稳定的络合物,然后用适当的有机溶剂将它们分离并提取目标金属和化合物。常用的萃取剂有(2,4,4-三甲基戊基)磷酸(Cyanex272)、(2-乙基己基磷酸-单-2-乙基己基)脂肪(PC88A)、(2-乙基己基磷酸单-2-乙基)己基脂肪(P507)、三乙酸(TOA)和二-(2-乙基己基)磷酸(D2EHPA)。目前,主要的工艺是废旧锂离子电池正极材料浸出液依次用沉淀剂去除铜,碳酸钠调整浸出液的pH去除铁和铝杂质,D2EHPA净化去除杂质,D2EHPA萃取锰,P507逐步萃取钴和镍(图1)。但是P507的分离系数有限,因此对高镍型正极废液的分离存在困难。Cyanex272的镍和钴的分离系数大于P507,可以用来萃取高镍低钴的溶液。然而,这种方法也有缺点;逐一分离镍、锰、钴容易导致镍和锂有价值金属的损失,导致金属离子的整体回收率低。在此基础上,多种萃取剂的协同萃取可以增加离子之间的选择性。目前,已经开发出一种新的萃取剂,用于同时萃取过渡金属:镍、钴和锰。通过萃取分离得到的锰、钴、镍混合溶液可以直接作为NCM正极材料前驱体系统的原料液。通过这种一步法实现过渡金属和锂组分的分离,是废旧锂电池浸出液中金属离子萃取研究的新趋势。文献中已经报道,BC196萃取剂可以同时萃取金属镍、钴和锰,并且与杂质离子的分离效果好(图2)。
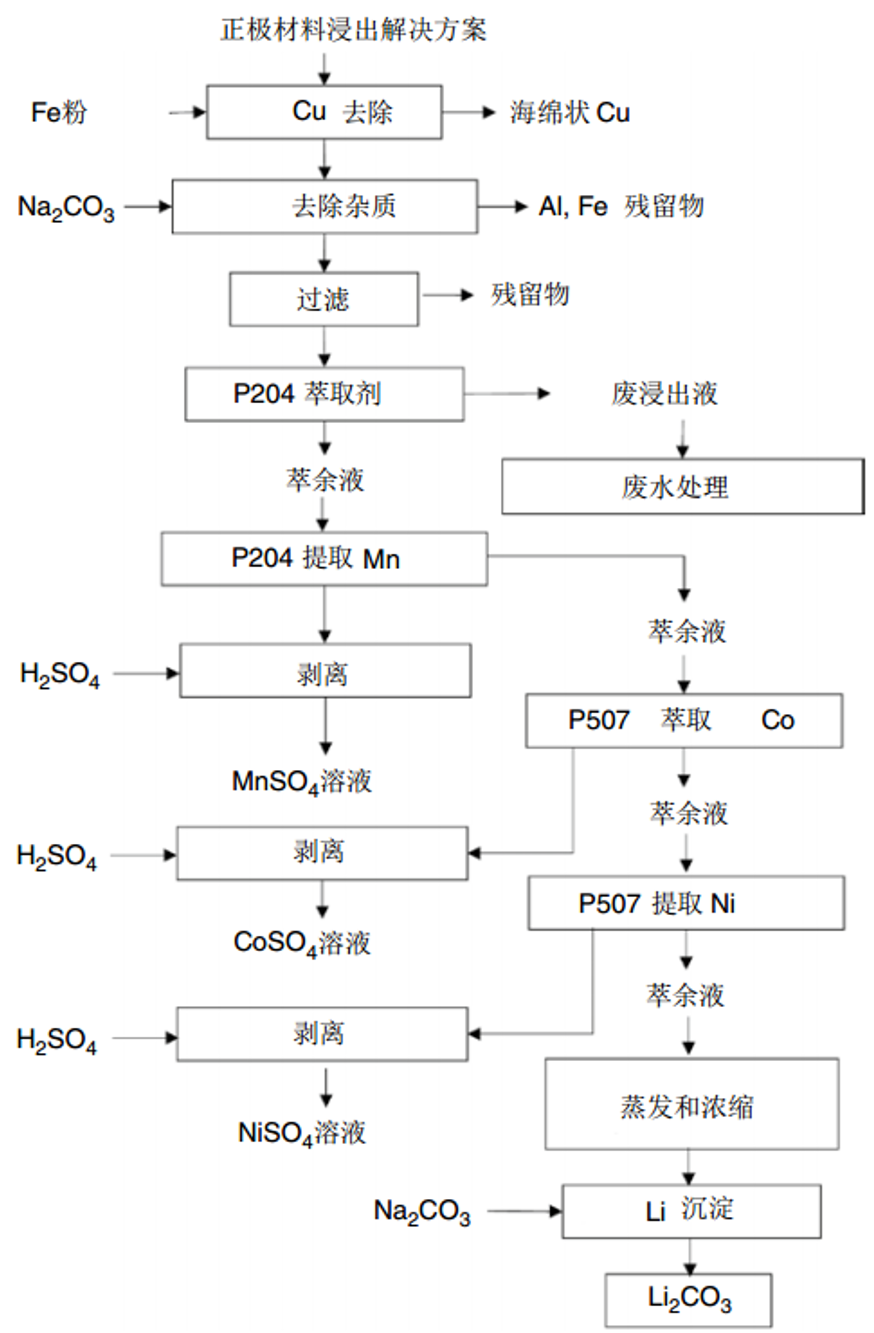
图1 溶剂萃取与沉淀相结合以回收浸出液中有价值金属离子的过程
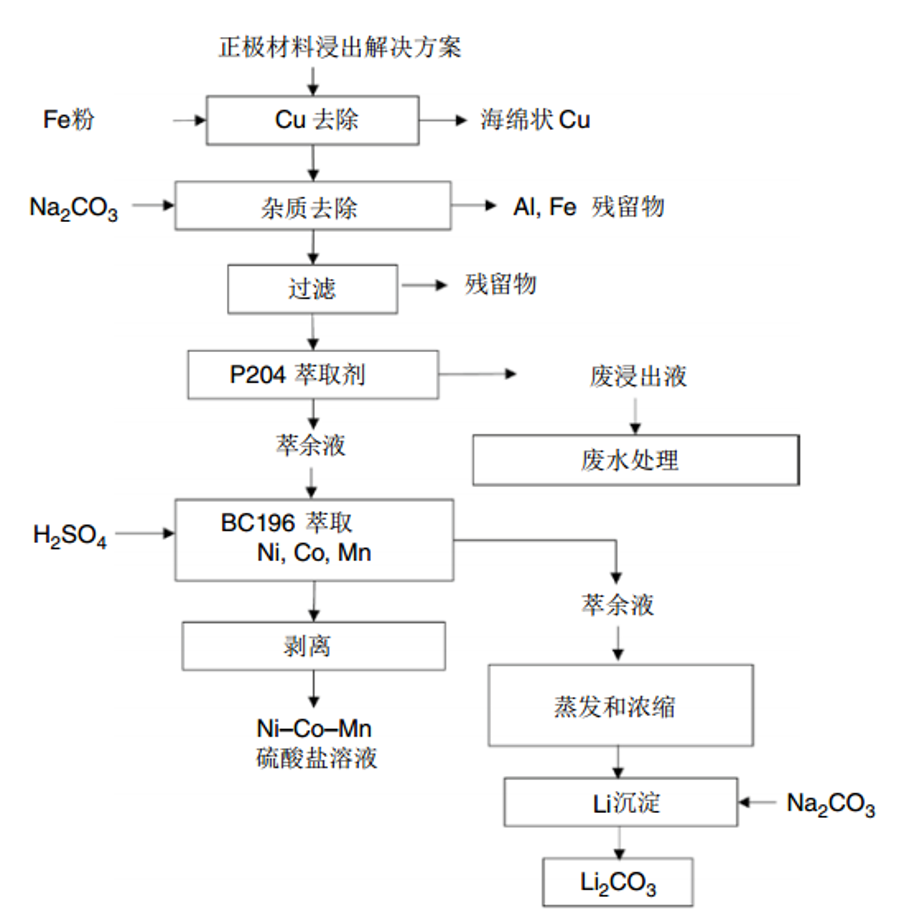
图 2结合溶剂萃取和沉淀回收浸出液中有价值金属离子的新工艺
化学沉淀法是向浸出液中添加特定的沉淀剂,使金属浸出液中的金属离子沉淀出来,得到相应的金属化合物产品。化学沉淀法的核心是控制溶液的pH,使相应的金属离子在不同的pH下沉淀。常用的沉淀剂有氢氧化钠(NaOH)、高锰酸钾(KMnO4)、丁二酮肟(C4H8N2O2)、碳酸钠等。
除了前面提到的使用沉淀法去除浸出液中的铁和铝杂质外,化学沉淀法主要用于通过调节溶液pH,沉淀Li+,然后添加饱和碳酸钠溶液得到Li2CO3沉淀;经过酸洗反溶液后,反溶液再次沉淀锂,得到高纯度的碳酸锂。Nayl等人用NaOH调节浸出液pH,并逐步添加饱和Na2CO3溶液沉淀Mn2+、Ni2+、Co2+和Li+。在浸出液pH为7.5时,可以将Mn2+沉淀为MnCO3,通过调节pH至9,可以将Ni2+沉淀为NiCO3。通过调节浸出液pH至11-12,得到Co(OH)2。最后,将剩余溶液中的Li+作为Li2CO3沉淀,该方法的Mn、Ni、Co和Li的沉淀率分别为94%、91%、95%和90%。Sattar等人控制漂白液的pH为2.5,添加KMnO4选择性地氧化Mn2+为MnO2进行去除,然后控制溶液pH为5,添加丁二酮肟沉淀Ni2+。Co2+被Cyanex272萃取,H2SO4反向萃取得到CoSO4溶液,最后调节萃取残液pH 12并添加Na2CO3沉淀Li+,得到Li2CO3沉淀。该方法的Li、Ni、Mn和Co的回收率分别为99%、>99%、>98%和99.9%。
化学沉淀法只需要控制溶液的pH并添加特定的沉淀剂,具有较高的回收率和较低的成本,易于实现工业生产。然而,由于浸出液中含有多种金属离子,在沉淀过程中不可避免地会发生金属离子的包裹,导致最终得到的沉淀产品中含有杂质,纯度低。
电化学方法,也称为电沉积方法,可以处理废旧的锂酸钴电池。在浸出液中,Co3+通过电化学还原技术转化为Co2+,最后在阳极沉积为Co(OH)2。这种方法不需要添加其他物质,不易引入杂质,可以获得非常纯净的钴化合物,直接用于制备电极材料。但是,缺点是消耗大量的电力。
离子交换法利用Co和Ni等不同金属离子络合物在离子交换树脂上的吸附能力差异,实现金属的分离和提取。该方法对目标离子具有选择性,操作简单,易于操作。它为从废旧锂电池中提取和回收有价值的金属提供了一种新的途径,但高成本限制了其工业应用。
上一篇:锂电池回收预处理技术
下一篇:火法冶炼回收锂电池工艺详解


 首页
首页
 检测领域
检测领域
 服务项目
服务项目
 咨询报价
咨询报价